*: Unterschied zwischen den Versionen
(→Leere Seite) |
|||
| Zeile 7: | Zeile 7: | ||
__NOTOC__ | __NOTOC__ | ||
| − | === | + | ==Praktikum: Bestimmung von Energie- und Entropiekapazität von Wasser und Wasserdampf== |
| − | ====[[ | + | ===Aufbau:=== |
| − | + | [[Bild:Versuchsaufbau_Energie_Entropiekapazität.jpg|thumb|right|Der Versuchsaufbau]] | |
| − | :''' | + | :'''Materialien:''' |
| − | : | + | :1. Behälter(Plastikeimer ca. 1 Liter, Styroporbecher ca. 1/2 Liter, etc.) |
| − | + | :2. 1 Tauchsieder (ca.230W/ca.1000W) | |
| − | + | :3. Bestimmte Menge Wasser | |
| − | : | + | :4. Stoppuhr |
| − | : | + | :5. Waage |
| − | : | + | :6. Leistungsmesser |
| − | + | :7. Thermometer | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | '''Zu messsen:''' | |
| − | + | Das Ziel ist es, herauszufinden wieviel Entropie und Energie sich in Wasser und Wasserdampf befindet. | |
| − | + | ||
| − | + | ||
| − | + | Dazu erhitzt man eine gewisse Menge Wasser mit einem Tauchsieder und läßt es dann eine Weile kochen. Durch Messung der Leistung des Tauchsieders bestimmt man die zugeführte Energiermenge. | |
| − | + | Während des Erwärmens wird ständig die Temperatur und die verstrichene Zeit gemessen und danach auch die Menge des verdampften Wassers bestimmt. | |
| − | ====[[ | + | |
| − | + | :1) Erstelle zunächst ein Diagramm des zeitlichen Temperaturverlaufs T(t). (T ist die absolute Temperatur in Kelvin.) Wie interpretieren Sie den Verlauf? | |
| + | :2) Bestimme die Wärmeenergiekapazität und die Verdampfungsenergie von Wasser. (In der Chemie spricht man von Verdampfungsenthalpie oder der latenten Wärme.) | ||
| + | :3) Berechne die Stärke des Entropiestroms bei einer Temperatur von 100°C. Berechne daraus wieviel Entropie man benötigt, um ein Kilogramm Wasser der Temperatur 100°C zu verdampfen. | ||
| + | :4) Trage in einem Diagramm die Entropiestromstärke (<math>I_S= \dot S</math>) über die Zeit auf. Bestimme daraus die Entropiemenge, die man bei der Erwärmung des Wassers benötigt hat. | ||
| + | |||
| + | ===Beobachtung:=== | ||
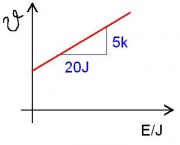
| + | [[Bild:Diagramm.jpg|thumb|Theta/J.]] | ||
| + | Die Temperatur nimmt mit der Zeit gleichmäßig zu. Deshalb nimmt auch die Energiemenge gleichmäßig zu! | ||
| + | |||
| + | Die Entropieströmung <math>I_S = I_E / T</math> nimmt mit der Zeit ab, weil der Energiestrom konstant bleibt. Das kann man vergleichen mit dem Aufpumpen eines Reifens mit konstanter Leistung. Durch die Zunahme der Druckdifferenz nimmt die Luftströmung ab. Oder mit dem Laden eines Kondensators mit konstanter Leistung. Durch die Zunahme der Spannung nimmt die Stromstärke ab. | ||
| + | |||
| + | ===Erklärung=== | ||
| + | '''(1)''' Bei der Erwärmung ist die Energiezufuhr konstant. Die Wärmekapazität von Wasser ist die Energiemenge pro kg und pro Kelvin: | ||
| + | :Energie in 20s: <math>E=288\,\rm W \cdot 20\, s = 5760\,\rm J</math> | ||
| + | :Das kann man nun auf ein Kilogramm hochrechnen: | ||
| + | Energie pro K: 1152J | ||
| + | Für 1 Kg: 3879J | ||
| + | Die Wärmekapazität von Wasser ist also ca. <math>3,9\frac{\rm kJ}{\rm kg \, K}</math> | ||
| + | -->Man benötigt um Wasser zu erwärmen 3,9 kJ Enrgie pro Kilogramm und pro Kelvin | ||
| + | |||
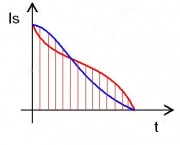
| + | '''(2)''' Bestimmung der hineingeflossenen Entropie | ||
| + | [[Image:Diagramm2.jpg|thumb|Die Änderung der Entropie, aufgetragen über die Zeit.]] | ||
| + | [[Bild:Funktion_Entropie_Temperatur_1kg_Wasser.jpg|thumb|Der Zusammenhang von Entropiegehalt und Temperatur bei 1kg Wasser.]] | ||
| + | |||
| + | :Der Entropiefluss hängt über die Temperatur direkt mit dem Energiefluss zusammen: | ||
| + | :<math>I_E = T \cdot I_S \ \Leftrightarrow \ \dot E = T \cdot \dot S</math> | ||
| + | :<math>\Rightarrow \dot S = \frac{1}{T} \cdot \dot E = \frac{1}{T} \cdot P </math> | ||
| + | :Man erhält die Entropiemenge, indem man über die Änderung der Entropie integriert. Dazu berechnet man <math>\frac{1}{T} \cdot P </math> für alle gemessenen Zeitpunkte und trägt es in einem Diagramm auf. Die Fläche unter dem Diagramm ist die hineingeflossene Entropiemenge. Offensichtlich benötigt man zu Beginn der Erwärmung mehr Entropie als am Ende. | ||
| + | :Da die Abnahme des Entropiestrom annähernd linear verläuft, kann man ohne großen Fehler die mittlere Entropiestromstärke aus der mittleren Temperatur <math>\bar T</math> berechnen: <math>\bar I_S \approx P/{\bar T}</math>. Man erhält dann für die Zunahme der Entropie: | ||
| + | :<math>S = \bar I_S \quad t = E / \bar T</math> | ||
| + | :Die Entropiezunahme ist also ungefähr gleich der Energiemenge dividiert durch mittlere Temperatur. | ||
Version vom 23. Mai 2023, 12:58 Uhr
Leere Seite
Praktikum: Bestimmung von Energie- und Entropiekapazität von Wasser und Wasserdampf
Aufbau:
- Materialien:
- 1. Behälter(Plastikeimer ca. 1 Liter, Styroporbecher ca. 1/2 Liter, etc.)
- 2. 1 Tauchsieder (ca.230W/ca.1000W)
- 3. Bestimmte Menge Wasser
- 4. Stoppuhr
- 5. Waage
- 6. Leistungsmesser
- 7. Thermometer
Zu messsen: Das Ziel ist es, herauszufinden wieviel Entropie und Energie sich in Wasser und Wasserdampf befindet.
Dazu erhitzt man eine gewisse Menge Wasser mit einem Tauchsieder und läßt es dann eine Weile kochen. Durch Messung der Leistung des Tauchsieders bestimmt man die zugeführte Energiermenge. Während des Erwärmens wird ständig die Temperatur und die verstrichene Zeit gemessen und danach auch die Menge des verdampften Wassers bestimmt.
- 1) Erstelle zunächst ein Diagramm des zeitlichen Temperaturverlaufs T(t). (T ist die absolute Temperatur in Kelvin.) Wie interpretieren Sie den Verlauf?
- 2) Bestimme die Wärmeenergiekapazität und die Verdampfungsenergie von Wasser. (In der Chemie spricht man von Verdampfungsenthalpie oder der latenten Wärme.)
- 3) Berechne die Stärke des Entropiestroms bei einer Temperatur von 100°C. Berechne daraus wieviel Entropie man benötigt, um ein Kilogramm Wasser der Temperatur 100°C zu verdampfen.
- 4) Trage in einem Diagramm die Entropiestromstärke ([math]I_S= \dot S[/math]) über die Zeit auf. Bestimme daraus die Entropiemenge, die man bei der Erwärmung des Wassers benötigt hat.
Beobachtung:
Die Temperatur nimmt mit der Zeit gleichmäßig zu. Deshalb nimmt auch die Energiemenge gleichmäßig zu!
Die Entropieströmung [math]I_S = I_E / T[/math] nimmt mit der Zeit ab, weil der Energiestrom konstant bleibt. Das kann man vergleichen mit dem Aufpumpen eines Reifens mit konstanter Leistung. Durch die Zunahme der Druckdifferenz nimmt die Luftströmung ab. Oder mit dem Laden eines Kondensators mit konstanter Leistung. Durch die Zunahme der Spannung nimmt die Stromstärke ab.
Erklärung
(1) Bei der Erwärmung ist die Energiezufuhr konstant. Die Wärmekapazität von Wasser ist die Energiemenge pro kg und pro Kelvin:
- Energie in 20s: [math]E=288\,\rm W \cdot 20\, s = 5760\,\rm J[/math]
- Das kann man nun auf ein Kilogramm hochrechnen:
Energie pro K: 1152J
Für 1 Kg: 3879J
Die Wärmekapazität von Wasser ist also ca. [math]3,9\frac{\rm kJ}{\rm kg \, K}[/math] -->Man benötigt um Wasser zu erwärmen 3,9 kJ Enrgie pro Kilogramm und pro Kelvin
(2) Bestimmung der hineingeflossenen Entropie
- Der Entropiefluss hängt über die Temperatur direkt mit dem Energiefluss zusammen:
- [math]I_E = T \cdot I_S \ \Leftrightarrow \ \dot E = T \cdot \dot S[/math]
- [math]\Rightarrow \dot S = \frac{1}{T} \cdot \dot E = \frac{1}{T} \cdot P [/math]
- Man erhält die Entropiemenge, indem man über die Änderung der Entropie integriert. Dazu berechnet man [math]\frac{1}{T} \cdot P [/math] für alle gemessenen Zeitpunkte und trägt es in einem Diagramm auf. Die Fläche unter dem Diagramm ist die hineingeflossene Entropiemenge. Offensichtlich benötigt man zu Beginn der Erwärmung mehr Entropie als am Ende.
- Da die Abnahme des Entropiestrom annähernd linear verläuft, kann man ohne großen Fehler die mittlere Entropiestromstärke aus der mittleren Temperatur [math]\bar T[/math] berechnen: [math]\bar I_S \approx P/{\bar T}[/math]. Man erhält dann für die Zunahme der Entropie:
- [math]S = \bar I_S \quad t = E / \bar T[/math]
- Die Entropiezunahme ist also ungefähr gleich der Energiemenge dividiert durch mittlere Temperatur.