Der Welle-Teilchen-Dualismus - Vorstufe zur Quantentheorie
(Kursstufe > Welle-Teilchen-Dualismus)
Zur Erklärung verschiedener Phänomene ist man gezwungen Licht entweder als elektromagnetische Welle oder als Teilchen zu beschreiben. Ebenso hat Materie wie Elektronen sowohl Teilchen- wie Welleneigenschaften. Wellen- und Teilchenmodell sind aber beide nicht allgemeingültig, sie erklären jeweils nur einen Aspekt. Es ist unbefriedigend den Photoeffekt im Teilchenmodell und die Interferenz am Doppelspalt im Wellenmodell erklären zu müssen. Ebenso ist der Teilchencharakter von Elektronen bei der Quantelung der Ladung im Millikan-Versuch oder durch die gesamte chemische Theorie des Atoms unbestreitbar und trotzdem zeigen sich Welleneigenschaften bei der Beugung an Kristallen. Diese unbefriedigende Situation wurde oder wird als Welle-Teilchen-Dualismus bezeichnet.
Wie kann man die Trennung in zwei unvereinbare Theorien überwinden und eine allgemeinere Theorie finden?
Inhaltsverzeichnis
Doppelspaltversuch mit Photonen und Elektronen
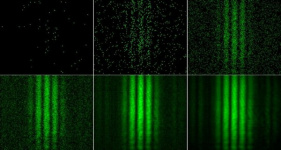
Bisher haben wir die Welleneigenschaften von Teilchen, wie zum Beispiel Elektronen, an der Interferenz in einem Kristallgitter nachweisen können. Noch übersichtlicher ist die Situation beim Doppelspalt. Wenn Teilchen wirklich auch Welleneigenschaften haben, was passiert, wenn ein Elektronenstrahl auf einen Doppelspalt trifft? Dieses Experiment wurde 1961 von C. Jönsson durchgeführt.
- Aufbau
Ein Elektronenstrahl trifft auf einen Doppelspalt. Die Spaltbreite betrug [math]0,5 \rm \mu m[/math] und der Spaltabstand [math]2 \rm \mu m[/math]. Hinter dem Doppelspalt befindet sich ein Schirm mit einer Photoschicht, welche die Abbildung der auftreffenden Teilchen ermöglicht. Im Strahlengang der Elektronen befinden sich mehrere "Linsen" aus elektrischen Felder, ähnlich wie bei einem Elektronenmikroskop.
- Beobachtung
Auf dem Schirm erkennt man helle und dunkle Streifen. Die hellen Streifen bestehen aus vielen hellen Punkten, bei den dunklen Streifen liegen die Punkte weniger dicht.
- Erklärung
Man betrachtet das Elektron einmal im Wellenmodell, dann wieder im Teilchenmodell: (Welle-Teilchen-Dualismus):
Im Wellenmodell:
Man kann dem Elektron nach de Broglie eine Wellenlänge aufgrund seines Impulses zuordnen. Damit berechnet man, wie bei der Interferenz von Wellen, die Intensität an verschiedenen Stellen des Schirms.
Im Teilchenmodell:
Jedes Elektron, das auf die Fotoplatte trifft, hinterläßt einen hellen Punkt. Ist die nach dem Interferenzmuster berechnete Intensität groß, so treffen dort viele Elektronen pro Fläche auf.
Der Wechsel zwischen den Modellen birgt aber Probleme in sich.
Einmal widersprechen sich die beiden Modelle in sich. Eine Welle besteht aus Schwingungen, die sich im Raum ausbreiten. Sie hat also eine Ausdehnung im Raum, eine Frequenz, eine Wellenlänge und eine Amplitude. Ein klassisches Teilchen, etwa ein Sandkorn, hat einen definierten Aufenthaltsort und keine Welleneigenschaften.
Weiterhin bedeutet dies für ein einzelnes Teilchen, dass es eine gewisse Wahrscheinlichkeit gibt an einer gewissen Stelle des Schirms aufzutreffen. Damit hat man grundsätzlich die Vorhersagbarkeit des Vorgangs aufgegeben und den Zufall in die Physik eingeführt!
Ein-Photonen-Experimente
Die Teilchen werden einzeln abgeschossen, trotzdem entsteht ein zusammenhängendes Muster. In der Geschichte der Physik hat man sich lange Zeit darüber gestritten, ob das echter Zufall ist. Die Wahrscheinlichkeit des Auftrittsortes lässt sich mathematisch bestimmen. Dazu wird eine eine ortsabhängige Wellenfunktion [math]\psi[/math] aufgestellt. Das Betragsquadrat der Wellenfunktion gibt die Aufenthaltswahrscheinlichkeit des Quantenobjektes an.
"Elektronenwolken" im Atom
Wie sieht ein Atom aus? Sicherlich nicht wie ein gewöhnlicher Gegenstand aus unserer makroskopischen Welt. Und trotzdem möchten wir uns eine ungefähre Vorstellung davon machen, wir denken uns ein Modell aus, dass gewisse Analoge Eigenschaften zum echten Atom hat.
Eine Möglichkeit ist das Bohrsche Atommodell mit Elektronen, die in festen Bahnen um den Kern kreisen. Dieses, vom Sonnensystem inspirierte Modell liefert einige gute Erklärungen und ist anschaulich. Es hat aber auch gravierende Mängel, was auch schon Niels Bohr bekannt war.
Eine weiterentwickelte Vorstellung, die letzlich auf der Quantentheorie beruht, ist die von "Elektronenwolken" oder einem verschmierten Elektronenstoff, dem "Elektronium". Auch dieses Modell ist nur eine Denkkrücke, aber wesentlich näher an der exakten Physik als Elektronenbahnen.
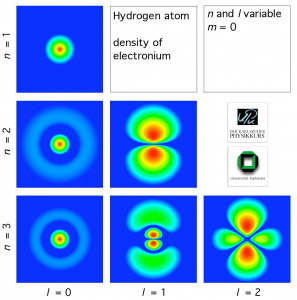
So sieht der Schnitt durch ein Wasserstoffatom mit einem Außenelektron aus. (Animationen der Uni Karlsruhe.)
Hier eine dreidimensionale Darstellung der Elektronenhülle bei verschiedenen Zuständen. (Aus dem HydrogenLab der Uni Karlsruhe)
Die Elektronenhülle des Wasserstoffatoms sieht je nach Anregungszustand unterschiedlich aus. Sie besteht aber nur aus einem Elektron! Dann stellt sich natürlich sofort die Frage, wo das Elektron denn nun ist. Die Antwort liefert eine Messung. Bei jeder Messung findet man das Elektron an verschiedenen Orten. Die Dichte der "Elektronenwolke" gibt die Aufenthaltswahrscheinlichkeit des Elektrons an.
In letzter Zeit ist es auch gelungen diese Aufenthaltswahrscheinlichkeit experimentell zu messen. Die gewonnenen Bilder ähneln sehr den Simulationen.
Fußnoten
- ↑ Bildrechte liegen bei A. Weis und T. L. Dimitrova Physics Department, University of Fribourg, Fribourg, Switzerland und University of Plovdiv "Paissi Hilendarski", Plovdiv, Bulgaria
Links
Doppelspalt
- Doppelspaltversuch mit Elektronen (Jönsson 1960) (LEIFI)
- Mehrfachspalt-Versuche mit Elektronen (Claus Jönssons Originalarbeit AJP Vol 42)
- Einiges Interessantes über den Doppelspalt: Simulationsprogramm von Klaus Muthsam, Video Einteilchenversuch mit Elektronen. (quantenphysik-schule.de von Wolf-Peter Hirlinger)
- Video-Comic: Dr Quantum - Double Slit Experiment (Welle-Teilchen Dualismus, Einteilchenversuche, 5min, eher inspirativ, etwas ungenau, falsche Aussage: Teilchen geht durch beide Spalte)
- Video-Dokumentation: Quantenmechanik - Doppelspalt, Verschränkung und Nichtlokalität 27min (youtube, von "Urknall, Weltall und das Leben" von Josef M. Gaßner und dem UWudL-Team ( ► www.Urknall-Weltall-Leben.de/team ) in Kooperation mit dem Verlag Komplett-Media.)
- Wikipedia: Bornsche Wahrscheinlichkeitsinterpretation
- Wikipedia: Max Born
- Ein-Photonen-Experiment mit Doppelspalt Schöne Simulation! (LEIFI)
- Interferenz von Fullerenen (Interferenz makroskopischer Objekte : Auf der Suche nach der Grenze zwischen der Quanten- und der klassischen Welt; von Katja Hagemann, Humboldt-Universität zu Berlin, 28.09.2009)
- Fullerene am Doppelspalt (Dr. Michael Komma)
- Video: Dr Quantum - Double Slit Experiment (Welle-Teilchen Dualismus, Einteilchenversuche)
- Artikel mit Foto: Einzelphotonen am Doppelspalt
- Simulationen zum Zeigermodell bei Quanten ("Feyn" von Matthias Amelunxen).
- The Strange Theorie of Light (Pfadsummen nach Feynman) (Ladislav Szántó)
- Chempedia: Reflektion am Spiegel durch Zeiger-Addition (Interferenz)
- Applet: Phasenzeiger der Zustandsfunktion, die einer ebenen Welle entspricht. (Jörg Bogendörfer Didaktik der Physik Uni Erlangen)
- Einiges Interessantes über den Doppelspalt: Simulationsprogramm von Klaus Muthsam, Video Einteilchenversuch mit Elektronen. (quantenphysik-schule.de von Wolf-Peter Hirlinger)
- LEIFI: Quantenphysik